近日,生物所微生物蛋白质工程创新团队梅子青课题组同清华大学合作,通过解析去泛素化酶UCHL3同K27二泛素复合物的高分辨率晶体结构,揭示了UCHL3识别K27泛素链(一类新型“泛素密码”)的分子机制,为基于调控“泛素密码”信号通路进行分子育种以及人兽共患重大疫病的防治奠定了基础。相关研究结果于2019年2月25日发表于化学类国际顶级期刊《德国应用化学杂志》(Angewandte Chemie International Edition,影响因子为12.102)上。
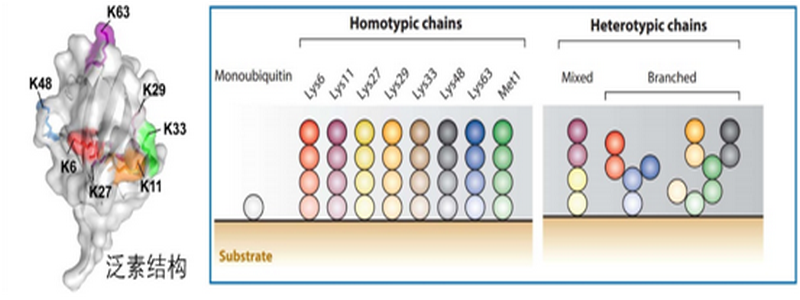
图1. 泛素密码:多种多样的泛素链赋予底物蛋白的不同命运.
泛素是一类在真核生物中普遍存在且高度保守的小分子多肽,其与底物蛋白质的结合过程被称为泛素化。蛋白质的泛素化是生物体内十分重要的翻译后修饰过程,在植物光合作用及抗逆、抗旱等多种生理过程中扮演重要调控角色,在病毒、病菌等致病微生物的侵入及畜禽等宿主免疫防御方面也同样具有重要作用。细胞内的泛素化形式多种多样,不同泛素链的分子结构特征,会赋予底物蛋白不同的生理调控角色,构成了具有重要表达调控意义的“泛素密码”(图1)。
近年来,“泛素密码”的识别调控已成为国际上生命科学领域的研究热点和前沿。在众多“泛素密码”中, K27泛素链修饰参与了DNA损伤修复、自免疫等过程。由于缺乏生化和结构证据,其识别调控的分子机制尚不明确,严重阻碍了对K27泛素链参与调控通路的有效干预。本研究整合化学生物学、生物物理学以及生物化学等手段,首次解析了去泛素化酶UCHL3同K27泛素复合物的晶体结构(图2),揭示了UCHL3对K27泛素链的分子识别机制,并进一步证明了UCHL3识别K27的独特结构特征。为基于调控K27 “泛素密码”信号通路进行分子育种以及人兽共患重大疫病的防治奠定了基础。
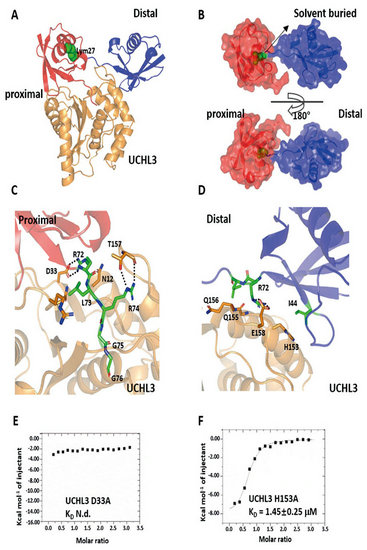
图2. 去泛素化酶UCHL3同K27二泛素复合物的晶体结构
自2015年加入中国农业科学院以来,梅子青课题组与合作者经过持续深入的研究,建立了泛素链化学合成及结构功能表征平台,先后解析多个关键蛋白复合物的结构特征,揭示相关生命过程的分子机制。本研究是该课题组继2016年的Proceedings of the National Academy of Sciences of the United States of America(《美国科学院院报》)、2017年的Angewandte Chemie International Edition(《德国应用化学杂志》)及2018年的Cell Research(《细胞研究》)之后,在泛素-26S蛋白酶体领域发表的第四篇高水平论文。该研究由中国农业科学院生物所和清华大学合作完成。生物所梅子青副研究员、清华大学刘磊教授以及陈春来教授为共同通讯作者,生物所硕士生丁珊为论文共同第一作者。
论文链接为 https://www.ncbi.nlm.nih.gov/pubmed/30589182


